Peptiede is 'n klas verbindings wat gevorm word deur die verbinding van veelvuldige aminosure deur peptiedbindings. Dit is alomteenwoordig in lewende organismes. Tot dusver is tienduisende peptiede in lewende organismes gevind. Peptiede speel 'n belangrike rol in die regulering van die funksionele aktiwiteite van verskillende stelsels, organe, weefsels en selle en in lewensaktiwiteite, en word dikwels gebruik in funksionele analise, teenliggaamnavorsing, geneesmiddelontwikkeling en ander velde. Met die ontwikkeling van biotegnologie en peptiedsintese -tegnologie, is al hoe meer peptiedmedisyne in die kliniek ontwikkel en toegepas.
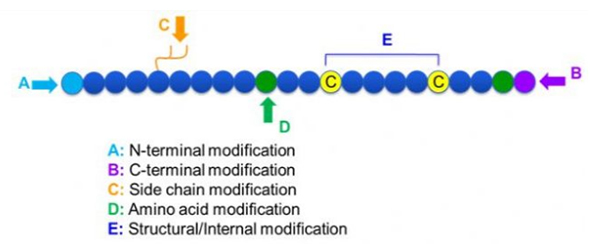
Daar is 'n groot verskeidenheid peptiedmodifikasies, wat eenvoudig verdeel kan word in na-modifikasie en prosesmodifikasie (met behulp van afgeleide aminosuurmodifikasie), en N-terminale modifikasie, C-terminale modifikasie, sykettingmodifikasie, aminosuurmodifikasie, skeletmodifikasie, ens., Afhangend van die modifikasieplek (Figuur 1). As 'n belangrike manier om die hoofkettingstruktuur of sykettinggroepe van peptiedkettings te verander, kan peptiedmodifikasie die fisiese en chemiese eienskappe van peptiedverbindings effektief verander, die oplosbaarheid van water verhoog, die aksietyd in vivo verleng, hul biologiese verspreiding verander, die immunogeniteit uitskakel, die giftige newe -effekte verminder, ens.
1. Siklisering
Sikliese peptiede het baie toepassings in biomedisyne, en baie natuurlike peptiede met biologiese aktiwiteit is sikliese peptiede. Aangesien sikliese peptiede geneig is om meer styf te wees as lineêre peptiede, is hulle buitengewoon bestand teen die spysverteringstelsel, kan dit in die spysverteringskanaal oorleef en 'n sterker affiniteit vir teikenreseptore vertoon. Siklisering is die mees direkte manier om sikliese peptiede te sintetiseer, veral vir peptiede met 'n groot strukturele skelet. Volgens die sikliseringsmodus kan dit verdeel word in die syketting -kettingtipe, terminale - sykettingtipe, terminale - terminale tipe (einde tot einde).
(1) Sidechain-to-sidechain
Die mees algemene tipe syketting aan siklus-siklisering is disulfiedbrug tussen cysteïne-residue. Hierdie siklisering word bekendgestel deur 'n paar cysteïne -residue wat ontneem word en dan geoksideer word om disulfiedbindings te vorm. Polisikliese sintese kan bereik word deur selektiewe verwydering van sulfhydryl -beskermingsgroepe. Siklisering kan gedoen word in 'n oplosmiddel na die dissosiasie of op 'n pre-dissosiasiehars. Siklisering op harsen kan minder effektief wees as oplosmiddel -siklisering, omdat die peptiede op hars nie geredelik gesiklifiseerde konformasies vorm nie. 'N Ander soort syketting -siklisering van die syketting is die vorming van 'n amiedstruktuur tussen 'n asparaginsuur of glutamiensuurresidu en die basisaminosuur, wat vereis dat die sykettingbeskermingsgroep selektief van die polipeptied op die hars of na dissosiasie verwyder moet word. Die derde tipe syketting-siklisering van die syketting is die vorming van difenieleters deur tyrosien of p-hidroksifenielglycine. Hierdie tipe siklisering in natuurlike produkte word slegs in mikrobiese produkte aangetref, en sikliseringsprodukte het dikwels potensiële medisinale waarde. Die voorbereiding van hierdie verbindings benodig unieke reaksietoestande, dus word dit nie gereeld gebruik in die sintese van konvensionele peptiede nie.

(2) Terminal-tot-Sidechain
Terminale ketting-siklisering behels gewoonlik die C-terminale met die aminogroep van die lysien of ornitien syketting, of die N-terminale met die asparaginsuur of glutamiensuur-syketting. Ander polipeptied -siklisering word gemaak deur eterbindings tussen terminale C en serien of treonien sykettings te vorm.
(3) terminale of kop-tot-stert tipe
Kettingpolipeptiede kan óf in 'n oplosmiddel fietsry óf op 'n hars aan die syketting -siklasie vasgemaak word. Lae konsentrasies peptiede moet in oplosmiddelsentralisasie gebruik word om oligomerisering van peptiede te vermy. Die opbrengs van 'n kop-tot-stert sintetiese ring polipeptied hang af van die volgorde van die kettingpolipeptied. Daarom, voordat u sikliese peptiede op groot skaal voorberei, moet 'n biblioteek met moontlike kettende loodpeptiede eers geskep word, gevolg deur siklisering om die volgorde met die beste resultate te vind.
2. N-metielering
N-metielering vind oorspronklik in natuurlike peptiede plaas en word in peptiedsintese ingebring om die vorming van waterstofbindings te voorkom, waardeur peptiede meer bestand is teen biodegradasie en opruiming. Sintese van peptiede met behulp van N-gemetileerde aminosuurderivate is die belangrikste metode. Daarbenewens kan mitsunobu-reaksie van n- (2-nitrobenzeen sulfonielchloried) polipeptied-resin-tussenprodukte met metanol ook gebruik word. Hierdie metode is gebruik om sikliese peptiedbiblioteke wat N-gemetileerde aminosure bevat, voor te berei.
3. fosforilering
Fosforylering is een van die algemeenste post-translasionele modifikasies in die natuur. In menslike selle word meer as 30% van die proteïene gefosforileer. Fosforilering, veral omkeerbare fosforilering, speel 'n belangrike rol in die beheer van baie sellulêre prosesse, soos seintransduksie, geenuitdrukking, selsiklus en sitoskeletregulering en apoptose.
Fosforilering kan by 'n verskeidenheid aminosuurreste waargeneem word, maar die algemeenste fosforilasieteikens is serien-, treonien- en tyrosienreste. Fosfotyrosien-, fosfothreonien- en fosfoserienderivate kan tydens sintese in peptiede óf in peptiede óf gevorm word na peptiedsintese. Selektiewe fosforilering kan bewerkstellig word met behulp van residue van serien, treonien en tyrosien wat beskermende groepe selektief verwyder. Sommige fosforilasie -reagense kan ook fosforsuurgroepe in die polipeptied inbring deur na modifikasie. In onlangse jare is terreinspesifieke fosforilering van lysien bereik met behulp van 'n chemies selektiewe Staudinger-fosfietreaksie (Figuur 3).

4. Myristoylering en palmitoylering
Asilering van die N-terminale met vetsure laat peptiede of proteïene aan selmembrane bind. Die Myridamoylated-volgorde op die N-terminale stel SRC-familieproteïenkinases in staat en omgekeerde transkriptase GAQ-proteïene kan gerig word om aan selmembrane te bind. Myristiese suur is gekoppel aan die N-terminale van die hars-polipeptied met behulp van standaardkoppelingsreaksies, en die resulterende lipopeptied kon onder standaardtoestande gedissosieer word en deur RP-HPLC gesuiwer word.
5. glikosilering
Glikopeptiede soos vankomisien en teikolanien is belangrike antibiotika vir die behandeling van geneesmiddelweerstandige bakteriële infeksies, en ander glikopeptiede word dikwels gebruik om die immuunstelsel te stimuleer. Aangesien baie mikrobiese antigene glikosileer is, is dit ook van groot belang om glikopeptiede te bestudeer vir die verbetering van die terapeutiese effek van infeksie. Aan die ander kant is daar gevind dat die proteïene op die selmembraan van tumorselle abnormale glikosilering vertoon, wat glikopeptiede 'n belangrike rol in kanker- en tumor -immuunverdedigingsnavorsing laat speel. Glikopeptiede word volgens FMOC/T-BU-metode voorberei. Glikosileerde residue, soos treonien en serien, word dikwels in polipeptiede ingevoer deur pentafluorofenol -ester -geaktiveerde FMOC's om glikosileerde aminosure te beskerm.
6. isopreen
Isopentadienylering vind plaas op cysteïne-residue in die syketting naby die C-terminale. Proteïen isopreen kan selmembraanaffiniteit verbeter en proteïen-proteïeninteraksie vorm. Isopentadiende proteïene sluit in tyrosienfosfatase, klein GTase, cochaperone -molekules, kernlamina en sentromere bindende proteïene. Isopreen -polipeptiede kan voorberei word met behulp van isopreen op hars of deur cysteïne -afgeleides bekend te stel.
7. Poliëtileenglikol (PEG) modifikasie
PEG -modifikasie kan gebruik word om proteïenhidrolitiese stabiliteit, biodistribusie en peptiedoplosbaarheid te verbeter. Die bekendstelling van PEG -kettings aan peptiede kan hul farmakologiese eienskappe verbeter en ook die hidrolise van peptiede deur proteolitiese ensieme belemmer. PEG -peptiede gaan makliker deur die glomerulêre kapillêre dwarssnit as gewone peptiede, wat die nieropruiming aansienlik verminder. As gevolg van die verlengde aktiewe halfleeftyd van PEG-peptiede in vivo, kan die normale behandelingsvlak gehandhaaf word met laer dosisse en minder gereelde peptiedmedisyne. PEG -modifikasie het egter ook negatiewe gevolge. Groot hoeveelhede PEG verhoed dat die ensiem die peptied afbreek en ook die binding van die peptied aan die teikenreseptor verminder. Maar die lae affiniteit van PEG-peptiede word gewoonlik teengewerk deur hul langer farmakokinetiese halfleeftyd, en deur langer in die liggaam teenwoordig te wees, het PEG-peptiede 'n groter waarskynlikheid dat dit in teikenweefsels opgeneem word. Daarom moet PEG -polimeerspesifikasies geoptimaliseer word vir optimale resultate. Aan die ander kant versamel PEG -peptiede in die lewer as gevolg van verminderde nieropruiming, wat lei tot makromolekulêre sindroom. Daarom moet PEG -modifikasies noukeuriger ontwerp word wanneer peptiede vir medisyne -toetsing gebruik word.

Algemene modifikasiegroepe van PEG-modifiseerders kan soos volg opgesom word: amino (-amien) -nh2, aminomethyl-ch2-nh2, hydroxy-oh, carboxy-cooh, sulfhydryl (-Thiol) -Sh, maleimied-mal, succinimide karbonaat -Sc, suig-aketaat-mal-sccinimide karbonaat -sc propionate -SPA, n-hydroxysuccinimide -NHS, Acrylate-ch2ch2cooh, aldehyde -CHO (such as propional-ald, butyrALD), acrylic base (-acrylate-acrl), azido-azide, biotinyl -Biotin, Fluorescein, glutaryl -GA, Acrylate Hidrasied, alkyne-alkyne, p-toluenesulfonaat -OTs, succinimide suksinaat-SS, ens. Amino-geaktiveerde PEG kan gekoppel word aan asparaginsuur of glutamiensuur sykettings. MAL-geaktiveerde PEG kan gekonjugeer word aan Mercaptan van volledig gedempeerde sistien-sykettings [11]. PEG-wysigers word gereeld soos volg geklassifiseer (let wel: MPEG is methoxy-PEG, CH3O- (CH2CH2O) N-CH2CH2-OH):
(1) Reguit kettingpen -wysiger
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-AlD, MPEG-Butyrald, MPEG-SS
(2) bifunksionele PEG -wysiger
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCL · NH2-PEG-COOH, MAL-PEG-NHS
(3) Vertakende PEG -wysiger
(MPEG) 2-NHS, (MPEG) 2-Ald, (MPEG) 2-NH2, (MPEG) 2-MAL
8. Biotinisering
Biotien kan sterk gebind word met avidien of streptavidin, en die bindingssterkte is selfs naby kovalente binding. Biotien-gemerkte peptiede word gereeld gebruik in immuno-toetsing, histositochemie en fluorescentie-gebaseerde vloei-sitometrie. Gemerkte antibiotien -teenliggaampies kan ook gebruik word om biotinylated peptiede te bind. Biotienetikette word dikwels aan die lysien -syketting of die N -terminale vasgemaak. 6-aminokaprosuur word dikwels gebruik as 'n binding tussen peptiede en biotien. Die binding is buigsaam in binding aan die substraat en bind beter in die teenwoordigheid van steriese hindernis.
9. fluoresserende etikettering
Fluoresserende etikettering kan gebruik word om polipeptiede in lewende selle op te spoor en om ensieme en werkingsmeganismes te bestudeer. Tryptofaan (TRP) is fluoresserend, dus kan dit gebruik word vir intrinsieke etikettering. Die emissiespektrum van tryptofaan hang af van die perifere omgewing en neem af met dalende oplosmiddelpolariteit, 'n eienskap wat nuttig is om peptiedstruktuur en reseptorbinding op te spoor. Tryptofaan -fluoressensie kan geblus word deur geprotoneerde asparaginsuur en glutamiensuur, wat die gebruik daarvan kan beperk. Die dansielchloriedgroep (dansiel) is baie fluoresserend as dit aan 'n aminogroep gebind is en word dikwels gebruik as 'n fluoresserende etiket vir aminosure of proteïene.
Fluorescentie -resonansie -energie -omskakeling (FRET) is nuttig vir ensiemstudies. As FRET toegepas word, bevat die substraatpolipeptied gewoonlik 'n fluorescentie-etiketteringsgroep en 'n fluorescentie-blusgroep. Gemerkte fluoresserende groepe word deur die blus geblus deur nie-foton-energie-oordrag. As die peptied van die betrokke ensiem gedissosieer word, gee die etiketteringsgroep fluoressensie uit.
10. hok polipeptiede
Hokpeptiede het opties verwyderbare beskermingsgroepe wat die peptied beskerm teen binding aan die reseptor. As dit aan UV -bestraling blootgestel word, word die peptied geaktiveer, wat die affiniteit van die reseptor herstel. Aangesien hierdie optiese aktivering volgens tyd, amplitude of ligging beheer kan word, kan hokpeptiede gebruik word om reaksies wat in selle voorkom, te bestudeer. Die mees gebruikte beskermende groepe vir hokpolipeptiede is 2-nitrobenzylgroepe en hul afgeleides, wat in peptiedsintese via beskermende aminosuurderivate bekendgestel kan word. Aminosuurderivate wat ontwikkel is, is lysien, cysteïne, serien en tyrosien. Aspartaat- en glutamaatderivate word egter nie gereeld gebruik nie as gevolg van hul vatbaarheid vir siklisering tydens peptiedsintese en dissosiasie.
11. poliantigeniese peptied (kaart)
Kort peptiede is gewoonlik nie immuun nie en moet aan draerproteïene gekoppel word om teenliggaampies te produseer. Poliantigeniese peptied (MAP) bestaan uit veelvuldige identiese peptiede wat aan lysienkerne gekoppel is, wat spesifiek hoë sterkte-immunogene kan uitdruk en gebruik kan word om peptied-draer-proteïenkoppels voor te berei. MAP -polipeptiede kan gesintetiseer word deur soliede fase -sintese op MAP -hars. Onvolledige koppeling lei egter tot ontbrekende of afgeknotte peptiedkettings op sommige takke en vertoon dus nie die eienskappe van die oorspronklike kaartpolipeptied nie. As alternatief kan peptiede afsonderlik voorberei en gesuiwer word en dan gekoppel word aan MAP. Die peptiedvolgorde wat aan die peptiedkern gekoppel is, is goed gedefinieër en word maklik gekenmerk deur massaspektrometrie.
Konklusie
Peptiedmodifikasie is 'n belangrike manier om peptiede te ontwerp. Chemies gemodifiseerde peptiede kan nie net 'n hoë biologiese aktiwiteit handhaaf nie, maar ook die nadele van immunogeniteit en toksisiteit effektief vermy. Terselfdertyd kan chemiese modifikasie peptiede met 'n paar nuwe uitstekende eienskappe gee. In onlangse jare is die metode van C-H-aktivering vir die post-modifisering van polipeptiede vinnig ontwikkel, en baie belangrike resultate is behaal.
Postyd: 2025-07-03
