Volgens die verbindingswyse van aminosuur en suiker, kan suikerpeptied in vier kategorieë verdeel word: O-glikosilering, C a N-glikosilering, dou-saccharifikasie en GPI (glikofosfatidlyinositol) verbinding.
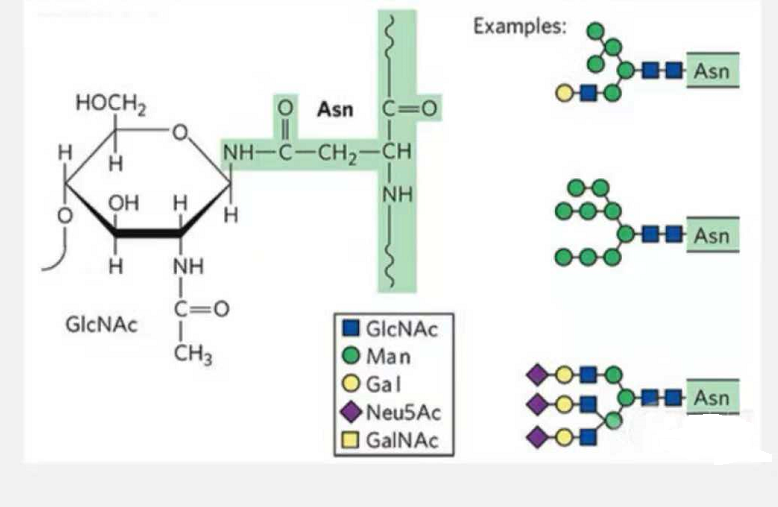
1. N-glikosileringsglikopeptiede is saamgestel uit N-asetamiedglukose aan die reducerende punt van die glikaanketting (Glc-Nac) gekoppel aan die N-atoom op die amiedgroep van die syketting van een of ander Asn in die peptiedketting, en die Asn wat in staat is om die glikaanketting te koppel, moet geleë wees in die AsN-X-Ser /Thr (X! =P) in die motief wat deur die residue gevorm word.Die suiker is N-asetielglukosamien.
N-glikosilering gemodifiseerde strukturele glikopeptied
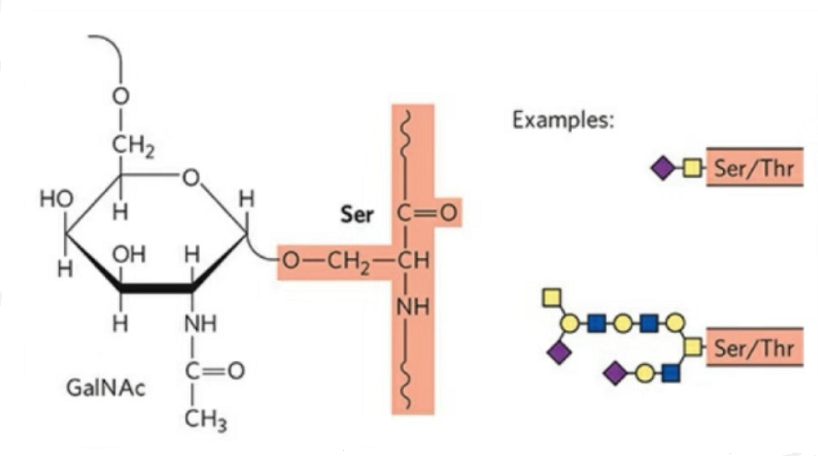
2. Die struktuur van O-glikosilering is eenvoudiger as N-glikosilering.Hierdie glikopeptied is oor die algemeen korter as die glikaan, maar het meer tipes as N-glikosilering.Ser en Thr kan oor die algemeen in die peptiedketting geglikosileer word.Daarbenewens is daar glikopeptiede versier met tyrosien-, hidroksiel- en hidroksiprolienglikosilering.Die skakelposisie is die hidroksiel suurstofatoom op die syketting van die residu.Die gekoppelde suikers is galaktose of N-asetielgalaktosamien (Gal&GalNAc) of glukose/glukosamien (Glc/GlcNAc), mannose/mannosamien (Man/ManNAc), ens.
O-glikosilering wysig die struktuur
3. Glikopeptied O-GlcNAC-glikosilering ((N-asetielsisteïen (NAC)) (glcnAcN-asetielglukosamien/asetielglukosamien)
'n Enkele N-asetielglukosamien (GlcNAc)-glikosilering verbind proteïene O-GlcNAc aan die hidroksiel suurstofatoom van die serien- of treonienresidu van 'n proteïen.O-GlcNA-glikosilering is O-GlcNAc-monosakkariedversiering sonder glikaanverlenging;Soos peptiedfosforilering, is O-GlcNAc-glikosilering van glikopeptiede ook 'n dinamiese proteïenversieringsproses.Abnormale O-GlcNAc-versiering kan 'n verskeidenheid siektes soos diabetes, kardiovaskulêre siektes, gewasse, Alzheimer se siekte ensovoorts veroorsaak.
Glikosileringspunte van glikopeptiede
Die basiese strukture van polipeptied- en suikerkettings word deur kovalente bindings aan proteïenkettings gekoppel, en die plekke wat die suikerkettings verbind, word glikosileringsplekke genoem.Aangesien daar geen sjabloon is om die biosintese van glikopeptiedsuikerkettings te volg nie, sal verskillende suikerkettings aan dieselfde glikosileringsplek geheg word, wat lei tot die sogenaamde mikroskopiese inhomogeniteit.
Glikosilering van glikopeptiede
1. Effek van glikopeptiedglikosilering op terapie-effektiwiteit van terapeutiese proteïene
In die geval van terapie-terapeutiese proteïene, beïnvloed glikosilering ook die halfleeftyd en teiken van proteïenmiddels in vivo
2. Oplosbare glikopeptiedglikosilering en proteïene
Studies het getoon dat suikerkettings op die oppervlak van proteïene die molekulêre oplosbaarheid van proteïene kan verbeter
3. Glikopeptiedglikosilering en proteïen-immunogenisiteit
Aan die een kant kan suikerkettings op die oppervlak van proteïene spesifieke immuunresponse veroorsaak.Aan die ander kant kan suikerkettings sekere oppervlaktes op die proteïenoppervlak bedek en die immunogenisiteit daarvan verminder
4. Glikopeptiedglikosilering wat proteïenstabiliteit verhoog
Glikosilering kan die stabiliteit van proteïene tot verskeie denatureringstoestande (soos denaturante, hitte, ens.) verhoog en die aggregasie van proteïene vermy.Terselfdertyd kan die suikerkettings op die oppervlak van proteïene ook sekere proteolitiese afbreekpunte van proteïenmolekules dek, en sodoende die weerstand van proteïene teen proteïenase verhoog.
5. Glikopeptiedglikosilering wat die biologiese aktiwiteit van proteïenmolekules beïnvloed
Veranderende proteïenglikosilering kan ook proteïenmolekules in staat stel om nuwe biologiese aktiwiteite te vorm
Postyd: Aug-03-2023